Concentração em Mol/L ou Molaridade
A concentração em quantidade de matéria (mol/L) é a expressão de concentração mais utilizada ao se trabalhar com soluções

Consideremos o suco gástrico que nosso estômago produz, com a finalidade de realizar o processo de digestão. Na realidade, trata-se de uma solução de ácido clorídrico (HCl) em uma concentração de 0,01 mol/L. Isso significa que para cada litro de suco gástrico, há 0,01 mol de HCl.
A concentração em quantidade de matéria é muitas vezes chamada por alguns autores de concentração molar ou molaridade, porém, os termos corretos são“concentração em mol/L” ou“concentração em quantidade de matéria”.Além disso, essa concentração é a mais recomendada pelo Sistema Internacional de Unidades (SI) e pela União Internacional de Química pura e Aplicada (IUPAC); portanto, ela é a mais usada em laboratórios e indústrias químicas.
A fórmula matemática usada para calcular essa concentração é dada por:

Porém, em muitos casos não é fornecido o valor da quantidade de matéria do soluto, mas sim a sua massa, expressa em gramas (m1). Nesses casos, temos que a quantidade de matéria do soluto em mols (n1) pode ser conseguida pela divisão da massa do soluto pela massa molar do próprio soluto, conforme a fórmula abaixo:

Substituindo n1 na equação, temos:
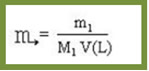
Considere o seguinte exemplo abaixo para visualizar como é feito esse cálculo:
“Uma solução aquosa com 100 mL de volume contém 20 g de NaCl. Como proceder para expressar a concentração dessa solução em quantidade de matéria por volume?”
Resolução:
Bom, a fórmula a ser utilizada é a mesma acima, porém o volume não está em litros. Assim, devemos fazer a seguinte conversão de unidades:
1 L ------ 1000 mL
V ------ 100 mL
V = 0,1 L
V ------ 100 mL
V = 0,1 L
Também é necessário descobrir o valor da massa molar do sal NaCl. Para tal, é preciso saber os valores das massas atômicas de ambos os elementos e realizar o cálculo da massa molar.
M (NaCl) = 1 . 23+ 1 . 35, 46
M (NaCl) = 58,46 g/mol
Agora sim podemos substituir todos os valores na fórmula e descobrir o valor da concentração em mol/L:

TÍTULO - PORCENTAGEM EM MASSA
T (%m/m)
O título é normalmente representado pela letra grega tau (τ) e é calculado pela fórmula matemática abaixo:

Onde:
m1 = massa do soluto em gramas;
m2 = massa do solvente em gramas;
m = massa da solução em gramas.
m2 = massa do solvente em gramas;
m = massa da solução em gramas.
Visto que é medida em massa tanto no numerador quanto no denominador, ou seja, como a unidade será a mesma; elas irão se anular, resultando em o título ser um número adimensional, puro, sem unidade. Além disso, ele pode ser usado para calcular a concentração das substâncias em qualquer estado físico.
O valor do título será sempre menor que a unidade, pois a massa do soluto é sempre menor que a da solução.
Assim, se dissermos que o título de determinada solução é igual a 0,4, isso significa que em uma unidade em massa da solução há 0,4 unidades em massa de soluto e 0,6 unidades em massa do solvente.
Por meio dessa relação, pode-se concluir que o título também pode ser calculado como porcentagem, basta multiplicar por 100%. Desse modo, temos a fórmula da porcentagem em massa do soluto, expressa abaixo:

Um exemplo comum em nosso cotidiano é a porcentagem em massa do soro fisiológico. O soro fisiológico é, na verdade, uma solução de água destilada com NaCl. Assim, quando vemos em seus rótulos a porcentagem em massa igual a 0,9%, isso significa que 100g da solução contêm 0,9 grama de NaCl. Dessa forma, podemos concluir que seu título é igual a 0,009.

EXERCÍCIOS
1)
Se 4,5 g de amônia NH3 forem dissolvidos em
3,30 x 102 g de água, qual será a fração molar da amônia na solução
resultante? Dados PM(amônia)=17 g/mol, PM(água)=18 g/mol.
2)
Se 4,5 g de amônia NH3 forem dissolvidos em
3,30 x 102 g de água, qual será a percentagem de amônia em massa
(%(m/m))?
3)
Se temos uma solução de massa 250 g e que contém 5 g de
amônia dissolvidas qual será a percentagem em massa da amônia, %(m/m), na
solução?
4)
Como você prepararia 100 mL de AgNO3 a
2,5%(m/v)?
5)
Quantos gramas de cloreto de potássio (KCl) são
necessários para preparar 500 mL de: a) uma solução a 0,25%(m/v), b) uma
solução 1,6%(m/v).
6)
Que massa de amônia está presente em 1 kg de uma
solução 29%(m/m)?
7)
Que massa de soluto é necessária para preparar 10 g de
uma solução a 28%(m/m) de hidróxido de sódio?
8)
De que volume de álcool você necessita para preparar
750 mL de uma solução aquosa a 2,1%(v/v)?
9)
Calcule a massa necessária de KMnO4
necessária para preparar: a) 5 L de uma solução a 0,12%(m/v), b) 25 g de uma
solução 1,5%(m/m).
10) Uma
solução de iodeto de potássio, KI, contém 62,5 g de KI em 500 mL de solução.
Determine a molaridade (concentração mol/L) desta solução. Dado
PM(KI)=166g/mol.
11) Qual
a massa necessária de cloreto de amônio (NH4Cl) para o preparo de 1
litro (1 L) de solução de concentração 0,66 mol/L?
12) Qual
a concentração em mol/L de uma solução de sulfato de sódio, Na2SO4,
a 1,2%(m/v)? Dados de massas atômicas: Na=23g/mol, S=32g/mol, O=16g/mol.
13) Uma
garrafa de coca-cola de 500 mL contém 37 g de sacarose, C12H22O11.
Qual percentagem em massa/volume, %(m/v) e a concentração molar (molaridade,
mol/L) desta solução? Dados de massas atômicas: C=12g/mol, H=1g/mol, O=16g/mol.
14) Qual
a massa de cloreto de amônio, NH4Cl, necessária para o preparo de
750 mL de uma solução 0,33 mol/L? Dados de massas atômicas: N=14g/mol,
H=1g/mol, Cl=35,5 g/mol.
15) Solução
salina normal é uma solução aquosa de cloreto de sódio, NaCl, que é usada em
medicina porque a sua composição coincide com aquela dos fluídos do organismo.
Sua concentração é de 0,9%(m/v). Qual a molaridade (mol/L, concentração molar)
desta solução? Dados de massas atômicas: Na=23g/mol, Cl=35,5 g/mol.
16) 10,6
g de cloreto de amônio (NH4Cl) estão dissolvidos em 152,4 g de água.
Se a densidade da solução é de 1,02 g/mL, responda: a) qual a %(m/m) da
solução?, b) qual a %(m/v) da solução. c) qual a concentração molar de cloreto
de amônio na solução? Dados de massas atômicas: N=14g/mol, H=1g/mol,
Cl=35,5g/mol.
17) Qual
a molaridade de uma solução de iodeto de potássio (NaI) que encerra 45 g do sal
em 400 mL de solução? Dados de massas atômicas: Na=23g/mol, I=127g/mol.
18) Calcule
a massa de hidróxido de sódio, NaOH, necessária para preparar meio litro de uma
solução 0,2 mol/L. Dados de massas atômicas: Na=23g/mol, O=16g/mol, H=1g/mol.
19) Que
volume de solução 0,1 mol/L de KMnO4 contém 5 g de KMnO4?
Dados de massas atômicas: K=39g/mol, Mn=55g/mol, O=16g/mol.
20) Uma
pequena quantidade de benzeno, 4,84 g, quando líquido, ocupa o volume de 5,5 cm3.
Qual a densidade do benzeno?
21) Uma
moeda de ouro puro tem uma massa de 31,1 g. Qual deve ser o seu volume se a
densidade do ouro é de 19,3 g/cm3?
22) Uma
solução de glicose foi feita seguindo os seguintes passos: 1) Por meio de
balança analítica foi pesado 5 g de glicose. 2) Um balão volumétrico de 100 mL
seco e vazio foi pesado e sua massa foi de 45,32 g. 3) Os 5 gramas de glicose
foram transferidos para o balão e este foi preenchido com água até o menisco.
4) O balão volumétrico, com a solução, foi pesado novamente e a sua massa
mostrou ser de 150,32 g.
Pergunta: Qual
a densidade da solução de glicose?

.jpg)
Qual a resposta da décima oitava questão???
ResponderExcluir