Link para download do arquivo da aula
http://pt.scribd.com/doc/223244073/Quimica-Industrial-2a-Serie-Aula-Estudo-Do-Comportamento-Dos-Gases
JV QUÍMICA
sábado, 10 de maio de 2014
sexta-feira, 16 de agosto de 2013
quinta-feira, 27 de junho de 2013
DIGIECO - FACULDADE ALFA - UMUARAMA
Projeto DIGIECO
Conheça um pouco deste grande projeto
Hoje em dia, dados os avanços tecnológicos, é fundamental que todos tenham acesso a terminais de computadores. O fácil acesso a novas tecnologias tem gerado um grande e obsoleto lixo digital. A iniciativa deste projeto nasceu no Canadá, onde os computadores recuperados foram utilizados para informatizar a rede de escolas públicas. No Brasil, o governo federal lançou dentro do Programa Brasileiro de Inclusão Digital (PBID) - 2004 o projeto dos centros de reciclagem que tem por objetivo aproveitar os cerca de 70 mil equipamentos descartados somente dos órgãos públicos em projetos sociais de inclusão digital, como escolas, bibliotecas, telecentros e centros comunitários, e também pretende absorver computadores de empresas privadas por meio de doações e parcerias que serão criadas.
O DIGIECO, programa de reciclagem digital, promove duas ações paralelas benéficas para a população, o recolhimentos de Lixo Eletrônico que poderia prejudicar sua saúde e a do meio ambiente e a distribuição de equipamentos recuperados para entidades carentes e população de baixa renda. Serão aceitos no(s) centro(s) de descarte de lixo eletrônico: computadores, impressoras e outros equipamentos de eletrônicos.
Dos equipamentos e peças que não poderão ser reutilizados será feita a separação de todos os componentes (plástico, vidro, componentes eletrônicos, televisores, celulares, impressoras, etc.) e o material será encaminhado para empresas que trabalham especificamente com cada um deles.
O projeto envolve os acadêmicos dos cursos de Marketing, Processos Gerenciais e Sistemas para Internet, promovendo interação entre cursos e a fixação da multidisciplinaridade garantindo além da ação social, a colocação dos acadêmicos em contato com o mercado, com a prática e com as responsabilidades de uma empresa.
Entenda o Contexto
Como a tecnologia avança rapidamente para a criação de novas tendências torna rapidamente obsoleta a anterior, os eletroeletrônicos principalmente são trocados dentro de intervalos cada vez menores, o que acarreta um grande número de equipamentos sem uso e descartados.
Chumbo, mercúrio e cádmio. Esses são alguns dos elementos que estão nos computadores, celulares e TVs de plasma. A contaminação por estes elementos pode se pelo contato direto, no caso de pessoas que manipulam diretamente as placas eletrônicas e outros componentes perigosos dos eletrônicos nos lixões a céu aberto. Mas também pode acontecer de forma acidental. Quando um eletrônico é jogado em lixo comum e vai para em um aterro sanitário, há grandes possibilidades de que os componentes tóxicos contaminem o solo e cheguem até os lençóis freáticos, afetando também a água, segundo um especialista. Essa água pode ser usada para irrigação, para dar de beber ao gado e dessa forma, seja pela carne ou pelos alimentos, esses elementos podem chegar até o homem.
Embora os fabricantes estejam sendo pressionados a eliminar ou pelo menos reduzir o uso destes componentes nos produtos, os equipamentos mais antigos, que estão indo parar no lixo hoje, contém muitas destas substâncias e dar um destino ecologicamente correto ao lixo eletrônico não é uma tarefa fácil. A aprovação da Lei Nacional de Resíduos Sólidos que tramita na Câmara dos Deputados a 19 (dezenove) anos seria um item fundamental para garantir a responsabilização dos fabricantes pela destinação dos resíduos eletrônicos. Redes de coleta específica para estes materiais também é necessária para evitar que eles acabem no lixo comum. Para a consultora em minimização de resíduos e educação ambiental, Patricia Blauth, a redução do lixo eletrônico tem que passar também por uma revisão no comportamento de consumo e de comprometimento com o ambiente de todos os cidadãos. Assim, mais que uma tendência de mercado, o destino dos equipamentos eletroeletrônicos e digitais de forma final e ambientalmente correta é uma responsabilidade das empresas de forma social e ambiental.
A proposta deste projeto justifica-se por seus objetivos, a serem trabalhados através de duas ações paralelas, sendo, atender a necessidade de destinação dos rejeitos tecnológicos na cidade de Umuarama, através de um movimento social num primeiro foco e na continuidade firmando parcerias com a coleta seletiva da Prefeitura, com empresas de assistências técnica de informática, escolas, faculdades, órgãos públicos, e para destinação final dos resíduos, com empresas recicladoras de plástico, metais e fundição de metais preciosos e promover a inclusão digital por meio da distribuição de computadores remontados na tentativa de melhorar a vida de cidadãos que não possuem condições de adquirir um computador.
Objetivo Geral
Coleta e reciclagem de computadores para distribuição às entidades sociais de Umuarama e região e o tratamento dos resíduos tecnológicos do descarte de computadores e seus periféricos de forma ambientalmente correta proporcionando ao acadêmico oportunidades de trabalho, de formação profissional e educacional e de socialização.
segunda-feira, 15 de abril de 2013
AULA QUÍMICA BÁSICA - 13/04 - CURSO E COLÉGIO ALFA UMUARAMA
CURSO E COLÉGIO ALFA DE UMUARAMA 13/04/13
PROF. João Valdir Miranda (JV)
AULA 01
QUÍMICA BÁSICA
HISTÓRICO DO ESTUDO DOS MODELOS ATÔMICOS
ESTUDO DO ÁTOMO
http://pt.scribd.com/doc/136147311/AULA-13-04-13-ALFA-MODELOS-ATOMICOS
segunda-feira, 8 de abril de 2013
CINÉTICA QUÍMICA
CINÉTICA QUÍMICA
Em uma ou outra
ocasião, quem não desejou que transformações tais como o estrago de alimentos,
a queima de velas, o rachamento e o descascamento de pinturas e a ferrugem da lataria
dos automóveis ocorressem um pouco mais lentamente? E quem já não desejou que a
cicatrização de feridas, o cozimento de batatas, o endurecimento do concreto, o
crescimento de plantas e a desintegração de plásticos e outros objetos jogados
no lixo ocorressem mais rapidamente? As velocidades das reações químicas podem
ser extremamente lentas ou extremamente rápidas. O estudo dos fatores que
influenciam as velocidades das reações tem aplicações práticas óbvias. Além
disso, este estudo fornece informações valiosas de como as reações químicas
ocorrem na realidade.
A cinética química é o estudo
das velocidades e mecanismos das reações químicas. A velocidade de
uma reação é a medida da rapidez com que se formam os produtos e se consomem os
reagentes. O mecanismo de uma reação consiste na descrição detalhada da seqüência
de etapas individuais que conduzem os reagentes aos produtos. A equação simplificada
para uma reação não exibe essas etapas, mostrando apenas a modificação global,
resultado final de todas as etapas que participam do mecanismo. Muito do que conhecemos
sobre os mecanismos das reações provém do estudo das velocidades de reação e de
como são influenciadas por vários fatores. Em geral, a velocidade de uma reação
é determinada: (1) pelas propriedades dos reagentes, (2) pelas concentrações
dos reagentes e (3) pela temperatura. A velocidade pode ser influenciada,
ainda: (4) pelas concentrações de outras substâncias que não são os reagentes e
(5) pelas áreas das superfícies em contato com os reagentes.
Neste
capítulo introduzimos um novo símbolo, os colchetes [ ], que indicarão a concentração
da espécie que está representada no seu interior. Esta é uma convenção usual e
significa: concentração molar, a menos que uma outra unidade seja
especificada. Assim, por exemplo, "a concentração molar dos íons sódio”
será escrita [Na+].
VELOCIDADES
DE REAÇÃO E MECANISMOS: UMA RAPIDA INTRODUÇÃO
O
SIGNIFICADO DE VELOCIDADE
A velocidade de reação mede
quão rapidamente um reagente é consumido ou um produto é formado, durante a
reação. Para ver como as velocidades de reação podem ser descritas
quantativamente, considere a reação hipotética, homogênea (em fase única):
A + B --> C + D
Admita que A e B
são misturados no tempo t = 0 e que a concentração inicial de A é 10,00 mol/L.
Com a ocorrência da reação, [A] decresce, como é mostrado pela curva da Figura 13.1.
Expressar a velocidade da reação numericamente não é fácil, pois a velocidade
com que os reagentes são consumidos (e os produtos são formados) varia
constantemente. Diante desta dificuldade, como poderemos expressar a
velocidade? Uma solução para o problema é considerar a velocidade média de
desaparecimento de A (decréscimo de sua concentração) num certo intervalo de
tempo. A tabela seguinte mostra [A] num intervalo de 2 min (os pontos da tabela
estão representados no gráfico da Figura):
Tempo,
min
|
[A]
mol/L
|
0,0
|
10,00
|
2,0
|
6,69
|
4,0
|
4,48
|
6,0
|
3,00
|
8,0
|
2,00
|
10,0
|
1,34
|
12,0
|
0,90
|
14,0
|
0,60
|
16,0
|
0,40
|
A
velocidade média de desaparecimento de A durante o intervalo de tempo, t1 a t2 é definida como a variação da
concentração de A, Δ[A], dividida pelo correspondente intervalo de tempo, Δt, ou
Velocidade Média = [A]2 - [A]1 /t2-t1
Costuma-se expressar a velocidade da reação como
um número positivo, por este motivo, o sinal de menos antecede a fração. No
intervalo de t = 0,0 a
t = 16,0, a concentração de A decresce de 10,00 mol/L a 0,40 mol/L e a
velocidade média correspondente a estes 16 min é:
Velocidade Média = 0,40 - 0,10 / 16 - 0
Velocidade Média = 0,60 mol/L.min
VELOCIDADE DE UMA REAÇÃO QUÍMICA
A velocidade de
uma reação é expressa como a taxa de desaparecimento dos reagentes ou de
aparecimento dos produtos. Embora estas taxas sejam proporcionais, não são
necessariamente iguais. No exemplo a seguir, considere a reação hipotética:
Observação: A interpretação
adequada da expressão d/dt é
importante. O significado desta expressão é, simplesmente, uma taxa de variação
com o tempo. Observe, em particular, que a letra d não é um símbolo algébrico; em outras palavras, dt não significa "d vezes t", nem d/dt significa "d dividido por dt".
A expressão velocidade
de reação é vaga, a não ser que se especifique a taxa de variação. Assim, a
velocidade pode ser dada por qualquer uma das seguintes expressões:
Dada a equação Química GENÉRICA
aA + bB ---> cC + dD
Expressões:
- d[A]/dt - d[B]/dt d[C]/dt d[D]/dt
onde expressões negativas indicam decréscimo de um determinado componente, ou seja, consumo do reagente.
MECANISMOS DE REAÇÕES
O SIGNIFICADODE MECANISMO
A maioria das reações não ocorre em
uma única etapa, como descrita pela equação simplificada, mas em uma série de
etapas. Às vezes estas etapas se ordenam em uma seqüência simples, enquanto em
outros casos se relacionam de uma maneira mais complexa. As etapas que conduzem
os reagentes aos produtos e a relação entre estas etapas constituem o mecanismo
da reação. Observação: os mecanismos só podem ser determinados
experimentalmente.
Por exemplo, uma reação que ocorre
por um simples mecanismo de duas etapas, em fase gasosa e homogênea, é a reação
do mono cloreto de iodo com hidrogênio:
---
2ICl(g)
+ H2(g) -----> 2HCl(g)
+ I2(g) (equação simplificada)
O mecanismo desta reação, encontrado
experimentalmente, é:
Etapa
1: ICl + H2 -----> HI + HCl
Etapa
2: ICl + HI ------> I2 + HCl
A primeira etapa deste mecanismo
consiste na colisão das moléculas de ICl com as de H2. Elas reagem
para formar uma molécula de li e uma molécula de HCl. Na etapa 2, a molécula de HI colide e
reage com uma segunda molécula de ICl, formando uma molécula de I2 e
uma segunda molécula de HCl. A transformação completa é descrita pela equação global,
que pode ser obtida pela adição das equações correspondentes às duas etapas.
OBSERVAÇÃO: Uma questão não
muito óbvia é que, apesar de dizermos que a etapa 1 do mecanismo precede a
etapa 2, na realidade ambas ocorrem simultaneamente na mistura reagente. Esta
aparente contradição é desfeita quando consideramos um grande conjunto de
moléculas de ICl e H2. Não seria razoável supor que todas as
"colisões da etapa 2" ocorressem somente após a realização de todas
as "colisões da etapa 1". É verdade que as "colisões da etapa
2" não ocorrem enquanto não se forma uma molécula de HI na etapa 1, mas,
após a mistura inicial de ICl e H2, muitas "colisões da etapa
2" ocorrerão antes que todas as moléculas de H2 se esgotem na
etapa 1.
EXERCÍCIOS
01) A revelação de uma imagem fotográfica em um filme é um processo controlado pela cinética química da
redução do halogeneto de prata por um revelador. A tabela abaixo mostra o tempo de revelação de um
determinado filme, usando um revelador D-76.
nº de mols do revelador tempo de revelação (min)
24 6
22 7
21 8
20 9
18 10
A velocidade média (vm) de revelação, no intervalo de tempo de 7 min a 10 min, é:
a) 3,14 mols de revelador / min.
b) 2,62 mols de revelador / min.
c) 1,80 mols de revelador / min.
d) 1,33 mols de revelador / min.
e) 0,70 mol de revelador / min.
oxigênio por minuto. A velocidade de decomposição do peróxido em mol/min é:
Dado: O = 16 u.
a) 0,05.
b) 0,10.
c) 0,20.
d) 1,70.
e) 3,40.
03) Com relação à reação: 2 A + 3 B -----> 2 C + D podemos afirmar que:
a) os reagentes (A e B) são consumidos com a mesma velocidade.
b) a velocidade de desaparecimento de A é igual à velocidade de aparecimento de C.
c) a velocidade de aparecimento de D é três vezes maior que a velocidade de desaparecimento de B.
d) os produtos (C e D) são formados com a mesma velocidade.
e) a velocidade de desaparecimento de A é a metade da velocidade de aparecimento de D.
04) A velocidade média da reação N2 + 3 H2 ----> 2 NH3 vale 2 mols/min. A velocidade média em função do
hidrogênio vale:
a) 6 mols / min.
b) 3 mols / min.
c) 2 mols / min.
d) 0,5 mols / min.
e) 5 mols / min.
05) A formação do dióxido de carbono (CO2) pode ser representada pela equação:
C(s) + O2(g) CO2(g)
Se a velocidade de formação do CO2(g) for de 4 mol/min, o consumo de oxigênio, em mol/min, será:
a) 8.
b) 16.
c) 2.
d) 12.
e) 4.
06) Numa reação completa de combustão, foi consumido, em 5 minutos, 0,25 mol de metano,
que foi transformado em CO2 e H2O. A velocidade da reação será:
a) 0,80 mol/min.
b) 0,40 mol/min.
c) 0,05 mol/min.
d) 0,60 mol/min.
e) 0,30 mol/min.
07) A combustão da gasolina pode ser equacionada por C8H18 + O2 ----> CO2 + H2O
(equação não-balanceada). Considere que após uma hora e meia de reação foram produzidos 36 mols
de CO2. Dessa forma, a velocidade de reação, expressa em número de mols de gasolina consumida por
minuto, é de:
a) 3,00 mol/min.
b) 4,50 mol/min.
c) 0,10 mol/min.
d) 0,40 mol/min.
e) 0,05 mol/min.
08) A amônia é produzida industrialmente a partir do gás nitrogênio (N2) e do gás hidrogênio
(H2), segundo a equação: N2(g) + 3 H2(g) ---> 2 NH3(g). Numa determinada experiência, a velocidade média
de consumo de gás hidrogênio foi de 120g por minuto. A velocidade de formação do gás amônia, nessa
experiência, em mols por minuto, será de:
a) 10.
b) 20.
c) 30.
d) 40.
e) 50.
09) Nas reações químicas, de um modo geral, aumenta-se a velocidade da reação por meio
da elevação de temperatura. Isto ocorre porque aumenta:
I. a velocidade média das moléculas reagentes.
II. a energia cinética média das moléculas dos reagentes.
III. a freqüência das colisões entre as moléculas.
Das afirmações acima são corretas:
a) I apenas.
b) II apenas.
c) III apenas.
d) I e III apenas.
e) I, II e III.
10) O que você faria para aumentar a velocidade de dissolução de um comprimido efervescente
em água?
I) Usaria água gelada.
II) Usaria água a temperatura ambiente.
III) Dissolveria o comprimido inteiro.
IV) Dissolveria o comprimido em 4 partes.
Assinale das alternativas abaixo a que responde corretamente à questão.
a) I e IV.
b) I e III.
c) III.
d) II e III.
e) II e IV.
quinta-feira, 14 de março de 2013
HISTÓRICO DA QUÍMICA ORGÂNICA
HISTÓRIA DA QUÍMICA ORGÂNICA
O princípio do domínio da química é o domínio do fogo pelo Homo erectus. O fogo também permitia ao Homem aquecer-se nos dias de baixas temperaturas, assim como conservar melhor os alimentos recorrendo ao processo de fumagem - especialmente para conservar a carne e o peixe.
Civilização Egípcia
Na Civilização Egípcia a utilização de produtos e técnicas “científicas” era amplamente difundida: utilizavam o índigo (proveniente do anil) e a alizarina para tingir têxteis. Atualmente ainda se utiliza o índigo para tingir as calças de ganga, mas este corante é obtido por processos industriais.
 Ilustração 1 - O índigo é utilizado como corante nos blusões e nas calças de ganga.
Ilustração 1 - O índigo é utilizado como corante nos blusões e nas calças de ganga.A alizarina é um corante vermelho derivado da raiz da Rubia tinctorum. A palavra alizarina deriva do árabe al-usara, que significa sumo. A alizarina é também o nome genérico de uma variedade de corantes, tais como o “Verde Alizarina Cianina G” e o “Azul Brilhante Alizarina R” (Ferreira, Hulme, McNab, & Quye, 2004).
Por sua vez, os Fenícios utilizam um corante de cor púrpura, o qual era obtido a partir das glândulas branquiais do molusco Murex trunculus, para tingir tecidos. Todos estes corantes eram de origem orgânica, o que demonstra que o Homem possui um domínio da química orgânica desde o aparecimento da civilização (Ferreira, Hulme, McNab, & Quye, 2004).
O desenvolvimento da Química Orgânica
Com o culminar da Química Tradicional do Século XVIII, Torbern Olof BERGMANN (1735
1784), dividiu, em 1777, a Química em:
• QUÍMICA ORGÂNICA (Química dos compostos existentes nos organismos vivos)
• QUÍMICA INORGÂNICA (Química dos compostos existentes no reino animal)
Deste modo surgiu a distinção entre matéria orgânica e matéria inorgânica. No final do século XVIII e início do século XIX, os químicos começaram a dedicar-se ao estudo das substâncias encontradas em organismos vivos. Como todas as substâncias orgânicas conhecidas eram extraídas de animais e vegetais, os químicos supunham que elas não poderiam ser produzidas (sintetizadas) em laboratório.
TEORIA DO VITALISMO
Foi uma teoria formulada por Jons Jacob Berzelius (1807), a qual descrevia que a matéria orgânica só podia ser produzida pelos seres vivos – vis vitalis (força ou energia vital) inerente na própria vida. A base desta teoria era a dificuldade de obter matéria orgânica a partir de substâncias inorgânicas.
A primeira síntese… Em 1828, Friedrich Whöler, discípulo de Berzelius, foi o primeiro cientista a sintetizar um composto orgânico (ureia) a partir de um composto inorgânico (cianato de amônio).
Como Whöler sintetizou um composto orgânico a partir de um composto inorgânico, pôs em causa a Teoria do Vitalismo. Com o desenvolvimento da ciência e com o contributo de Berzelius percebeu-se que a definição de Bergman para a química orgânica não era adequada, então o químico alemão Friedrich August Kekulé propôs a nova definição aceita atualmente: “Química Orgânica é o ramo da Química que estuda os compostos do carbono”. Esta afirmação está correta, contudo, nem todos os compostos que contêm carbono são orgânicos, por exemplo, o dióxido de carbono, o ácido carbônico, a grafite, o diamante, etc, mas todos os compostos orgânicos contêm carbono e hidrogênio.
segunda-feira, 11 de março de 2013
Concentração Molar - Molaridade /// Título - Porcentagem em Massa
Concentração em Mol/L ou Molaridade
A concentração em quantidade de matéria (mol/L) é a expressão de concentração mais utilizada ao se trabalhar com soluções

Consideremos o suco gástrico que nosso estômago produz, com a finalidade de realizar o processo de digestão. Na realidade, trata-se de uma solução de ácido clorídrico (HCl) em uma concentração de 0,01 mol/L. Isso significa que para cada litro de suco gástrico, há 0,01 mol de HCl.
A concentração em quantidade de matéria é muitas vezes chamada por alguns autores de concentração molar ou molaridade, porém, os termos corretos são“concentração em mol/L” ou“concentração em quantidade de matéria”.Além disso, essa concentração é a mais recomendada pelo Sistema Internacional de Unidades (SI) e pela União Internacional de Química pura e Aplicada (IUPAC); portanto, ela é a mais usada em laboratórios e indústrias químicas.
A fórmula matemática usada para calcular essa concentração é dada por:

Porém, em muitos casos não é fornecido o valor da quantidade de matéria do soluto, mas sim a sua massa, expressa em gramas (m1). Nesses casos, temos que a quantidade de matéria do soluto em mols (n1) pode ser conseguida pela divisão da massa do soluto pela massa molar do próprio soluto, conforme a fórmula abaixo:

Substituindo n1 na equação, temos:
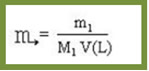
Considere o seguinte exemplo abaixo para visualizar como é feito esse cálculo:
“Uma solução aquosa com 100 mL de volume contém 20 g de NaCl. Como proceder para expressar a concentração dessa solução em quantidade de matéria por volume?”
Resolução:
Bom, a fórmula a ser utilizada é a mesma acima, porém o volume não está em litros. Assim, devemos fazer a seguinte conversão de unidades:
1 L ------ 1000 mL
V ------ 100 mL
V = 0,1 L
V ------ 100 mL
V = 0,1 L
Também é necessário descobrir o valor da massa molar do sal NaCl. Para tal, é preciso saber os valores das massas atômicas de ambos os elementos e realizar o cálculo da massa molar.
M (NaCl) = 1 . 23+ 1 . 35, 46
M (NaCl) = 58,46 g/mol
Agora sim podemos substituir todos os valores na fórmula e descobrir o valor da concentração em mol/L:

TÍTULO - PORCENTAGEM EM MASSA
T (%m/m)
O título é normalmente representado pela letra grega tau (τ) e é calculado pela fórmula matemática abaixo:

Onde:
m1 = massa do soluto em gramas;
m2 = massa do solvente em gramas;
m = massa da solução em gramas.
m2 = massa do solvente em gramas;
m = massa da solução em gramas.
Visto que é medida em massa tanto no numerador quanto no denominador, ou seja, como a unidade será a mesma; elas irão se anular, resultando em o título ser um número adimensional, puro, sem unidade. Além disso, ele pode ser usado para calcular a concentração das substâncias em qualquer estado físico.
O valor do título será sempre menor que a unidade, pois a massa do soluto é sempre menor que a da solução.
Assim, se dissermos que o título de determinada solução é igual a 0,4, isso significa que em uma unidade em massa da solução há 0,4 unidades em massa de soluto e 0,6 unidades em massa do solvente.
Por meio dessa relação, pode-se concluir que o título também pode ser calculado como porcentagem, basta multiplicar por 100%. Desse modo, temos a fórmula da porcentagem em massa do soluto, expressa abaixo:

Um exemplo comum em nosso cotidiano é a porcentagem em massa do soro fisiológico. O soro fisiológico é, na verdade, uma solução de água destilada com NaCl. Assim, quando vemos em seus rótulos a porcentagem em massa igual a 0,9%, isso significa que 100g da solução contêm 0,9 grama de NaCl. Dessa forma, podemos concluir que seu título é igual a 0,009.

EXERCÍCIOS
1)
Se 4,5 g de amônia NH3 forem dissolvidos em
3,30 x 102 g de água, qual será a fração molar da amônia na solução
resultante? Dados PM(amônia)=17 g/mol, PM(água)=18 g/mol.
2)
Se 4,5 g de amônia NH3 forem dissolvidos em
3,30 x 102 g de água, qual será a percentagem de amônia em massa
(%(m/m))?
3)
Se temos uma solução de massa 250 g e que contém 5 g de
amônia dissolvidas qual será a percentagem em massa da amônia, %(m/m), na
solução?
4)
Como você prepararia 100 mL de AgNO3 a
2,5%(m/v)?
5)
Quantos gramas de cloreto de potássio (KCl) são
necessários para preparar 500 mL de: a) uma solução a 0,25%(m/v), b) uma
solução 1,6%(m/v).
6)
Que massa de amônia está presente em 1 kg de uma
solução 29%(m/m)?
7)
Que massa de soluto é necessária para preparar 10 g de
uma solução a 28%(m/m) de hidróxido de sódio?
8)
De que volume de álcool você necessita para preparar
750 mL de uma solução aquosa a 2,1%(v/v)?
9)
Calcule a massa necessária de KMnO4
necessária para preparar: a) 5 L de uma solução a 0,12%(m/v), b) 25 g de uma
solução 1,5%(m/m).
10) Uma
solução de iodeto de potássio, KI, contém 62,5 g de KI em 500 mL de solução.
Determine a molaridade (concentração mol/L) desta solução. Dado
PM(KI)=166g/mol.
11) Qual
a massa necessária de cloreto de amônio (NH4Cl) para o preparo de 1
litro (1 L) de solução de concentração 0,66 mol/L?
12) Qual
a concentração em mol/L de uma solução de sulfato de sódio, Na2SO4,
a 1,2%(m/v)? Dados de massas atômicas: Na=23g/mol, S=32g/mol, O=16g/mol.
13) Uma
garrafa de coca-cola de 500 mL contém 37 g de sacarose, C12H22O11.
Qual percentagem em massa/volume, %(m/v) e a concentração molar (molaridade,
mol/L) desta solução? Dados de massas atômicas: C=12g/mol, H=1g/mol, O=16g/mol.
14) Qual
a massa de cloreto de amônio, NH4Cl, necessária para o preparo de
750 mL de uma solução 0,33 mol/L? Dados de massas atômicas: N=14g/mol,
H=1g/mol, Cl=35,5 g/mol.
15) Solução
salina normal é uma solução aquosa de cloreto de sódio, NaCl, que é usada em
medicina porque a sua composição coincide com aquela dos fluídos do organismo.
Sua concentração é de 0,9%(m/v). Qual a molaridade (mol/L, concentração molar)
desta solução? Dados de massas atômicas: Na=23g/mol, Cl=35,5 g/mol.
16) 10,6
g de cloreto de amônio (NH4Cl) estão dissolvidos em 152,4 g de água.
Se a densidade da solução é de 1,02 g/mL, responda: a) qual a %(m/m) da
solução?, b) qual a %(m/v) da solução. c) qual a concentração molar de cloreto
de amônio na solução? Dados de massas atômicas: N=14g/mol, H=1g/mol,
Cl=35,5g/mol.
17) Qual
a molaridade de uma solução de iodeto de potássio (NaI) que encerra 45 g do sal
em 400 mL de solução? Dados de massas atômicas: Na=23g/mol, I=127g/mol.
18) Calcule
a massa de hidróxido de sódio, NaOH, necessária para preparar meio litro de uma
solução 0,2 mol/L. Dados de massas atômicas: Na=23g/mol, O=16g/mol, H=1g/mol.
19) Que
volume de solução 0,1 mol/L de KMnO4 contém 5 g de KMnO4?
Dados de massas atômicas: K=39g/mol, Mn=55g/mol, O=16g/mol.
20) Uma
pequena quantidade de benzeno, 4,84 g, quando líquido, ocupa o volume de 5,5 cm3.
Qual a densidade do benzeno?
21) Uma
moeda de ouro puro tem uma massa de 31,1 g. Qual deve ser o seu volume se a
densidade do ouro é de 19,3 g/cm3?
22) Uma
solução de glicose foi feita seguindo os seguintes passos: 1) Por meio de
balança analítica foi pesado 5 g de glicose. 2) Um balão volumétrico de 100 mL
seco e vazio foi pesado e sua massa foi de 45,32 g. 3) Os 5 gramas de glicose
foram transferidos para o balão e este foi preenchido com água até o menisco.
4) O balão volumétrico, com a solução, foi pesado novamente e a sua massa
mostrou ser de 150,32 g.
Pergunta: Qual
a densidade da solução de glicose?
Assinar:
Postagens (Atom)





.jpg)