Aproximadamente 90% das reações químicas acontecem com os reagentes dissolvidos em algum líquido. Muitas das coisas que consumimos também são soluções. Daí a importância de entendermos algumas coisas sobre soluções.
Uma solução é sempre composta de duas coisas: uma que dissolve, que chamaremos de solvente, e outra que é dissolvida, que chamaremos de soluto. Assim, quando tomamos um susto e nossa avó prepara um copo de água com açúcar para que nos acalmemos, ela prepara uma solução onde a água é o solvente e o açúcar é o soluto. O que talvez ela não saiba é que água com açúcar não tem o mínimo efeito calmante...
Nosso "calmante da vovó" pode estar muito ou pouco doce. Quimicamente falando, o que está variando é a concentração. Quanto mais doce estiver, mais açúcar encontra-se dissolvido e mais concentrada a solução estará.
Concentração
A concentração é a relação entre a quantidade de soluto e o volume da solução. É bastante óbvio que se colocarmos uma colher de chá de açúcar em um copo com água o resultado será menos doce do que se colocarmos uma colher de sopa de açúcar no mesmo copo com água. A primeira solução é menos concentrada que a segunda, ou seja, possui menos massa de soluto do que a segunda, para o mesmo volume de solvente.
Matematicamente podemos escrever uma expressão para calcular a concentração:
Todos sabemos que a quantidade de soluto que pode ser adicionado a um solvente não é infinita. Se nossa avó, ao preparar nosso copo de água com açúcar, exagerar no açúcar, parte dele não será dissolvido, permanecendo sólido no fundo do copo. Podemos então concluir que existe um limite para a quantidade de soluto. É o que chamamos de
coeficiente de solubilidade.
As coisas agora podem parecer meio confusas, mas leia com atenção que você entenderá esses conceitos com clareza:
Concentração máxima
Temos um certo volume de solvente puro, ou seja, não adicionamos nada nele - ainda. Começamos a colocar vagarosamente pequenas quantidades de soluto. À medida que isso é feito, a concentração começa a aumentar. Continuamos adicionando soluto, a concentração continua aumentando até que colocamos uma pitada do soluto e este não mais se dissolve. Atingimos a máxima concentração que essa solução pode ter e, mesmo que adicionemos mais soluto, a concentração não se alterará mais.
Entenda que a concentração é a relação da massa do soluto dissolvido em um certo volume de solução. Se colocamos soluto em excesso e ele não se dissolver, ele não fará parte da solução, ficará depositado no fundo do recipiente no estado sólido e portanto não influenciará na concentração.
Perceba que isso nos remete a algo muito interessante: se gostamos de café bem doce, existe um limite de quantidade de açúcar que podemos colocar no café para que ele dissolva. Toda a quantidade que colocarmos a mais ficará depositada no fundo da xícara e não tornará o café mais doce, apenas desperdiçará mais açúcar.
Concentração e densidade
Algum leitor deve ter batido os olhos na figura da lousa e se perguntado: A relação da massa e volume não é a
densidade?
É sim, mas fique atento ao seguinte detalhe: embora possamos escrever as duas expressões como m/V, na concentração "m" representa a massa apenas do soluto, enquanto que na densidade o "m" representa a massa total da solução (soluto + solvente). Perceba também que quando a concentração aumenta (adição de soluto), a densidade também aumenta, pois estamos adicionando mais massa à solução.
Tipos de soluções
Dependendo da quantidade de soluto que uma solução contém, podemos classificar as soluções. Tenha novamente em mente que existe um limite para a quantidade de soluto que pode ser adicionado a um determinado volume de solvente e que chamamos isso de coeficiente de solubilidade.
Quando uma solução contém soluto abaixo do coeficiente de solubilidade, dizemos que essa solução é insaturada. Quando a quantidade de soluto é igual ao coeficiente de solubilidade, ou seja, está no limite, dizemos que ela é saturada. Finalmente, quando a quantidade de soluto supera o limite, dizemos que ela é super-saturada.
Você deve estar se perguntando como é possível ter uma quantidade de soluto superior ao limite. Afinal é o limite ou não? As soluções ditas super-saturadas, que contêm uma quantidade de soluto superior ao coeficiente de solubilidade são extremamente difícies de preparar e muito instáveis.
Imagine a seguinte situação: você quer empilhar latas de refrigerante e, o máximo que consegue empilhar são quatro latas. Você tentou empilhar milhões de vezes e o limite é quatro latas. De repente, você utiliza toda concentração e cuidado dignas de um monge budista e consegue empilhar a quinta lata. Nesse momento alguém bate a porta do seu laboratório e a quinta lata cai, restando apenas quatro empilhadas. Você se concentra novamente e consegue empilhar não cinco, mas seis latas! Nesse momento vem se aproximando da sua pilha um mosquito e pousa em cima dela, derrubando duas delas e restando novamente quatro empilhadas.
É isso que acontece nas soluções super-saturadas. Em condições especiais conseguimos dissolver uma quantidade de soluto superior ao coeficiente de solubilidade (CS) mas, na primeira perturbação o excedente se precipita restando dissolvida apenas a quantidade limite, o que torna a solução saturada.
Curva de solubilidade
A solubilidade varia de soluto para soluto e também com o tipo de solvente. Além disso, o principal fator que influencia na solubilidade é a temperatura. O coeficiente de solubilidade varia com a temperatura, podendo aumentar ou diminuir com a elevação de temperatura, depedendo do soluto em questão. A variação do coeficiente de solubilidade em função da temperatura é representado em um gráfico que chamamos de curva de solubilidade.
Queridos e amados alunos: Segue abaixo uma lista de exercícios para melhor compreensão e fixação do contexto acima descrito. Durante a semana disponibilizarei mais conteúdos e testes. Abraços! Ótimos estudos!
1. Qual
a concentração de uma solução contendo 40g de cloreto de sódio dissolvidos em
250 mL de solução? R:160
2. Uma solução foi preparada adicionando-se 40g de hidróxido
de sódio em água suficiente para produzir 200 mL de solução. Calcule a
concentração comum dessa solução. R:200
3. Calcule a concentração comum de uma solução de nitrato de
prata, sabendo que ela encerra 120g do sal em 600 cm3
de solução. R:200
4. Determine a massa de ácido nítrico, em gramas, necessária para a preparação de 150 mL de uma
solução
de
concentração 50g/L. R:7,5g
5. Calcule a concentração, em g/L, de uma solução aquosa de
nitrato de sódio que contêm 30g de sal em
400 mL de solução. R:7,5
6. Qual a concentração, em g/L, da solução obtida ao se
dissolverem 4g de cloreto de sódio em 50 cm3
de solução? R:80
7. São dissolvidos 24g de sacarose em água
suficiente para 500mL de solução. Qual é a concentração comum dessa solução?
R:48
8. Calcule a concentração comum de uma
solução que apresenta volume de 800mL e contém 80g de soluto. R:100
9. Evapora-se totalmente o solvente de 250 mL de uma
solução aquosa de cloreto de magnésio de concentração 8,0g/L. Quantos gramas de
soluto são obtidos? R:2
10. São dissolvidos 200g de cloreto de sódio
em água suficiente para 2
litros de solução. qual é a concentração comum dessa solução?
R:100
11. 300g de açúcar foram adicionados a uma
certa quantidade de água, obtendo-se uma solução 60g/L. Qual o volume dessa
solução, em mL? R:500
12. A concentração comum de uma solução é de
20g/L. Determine o volume, em mL, dessa solução, sabendo que ela contém 75g de
soluto. R:3750
13. O derramamento de óleo nos cursos d’água forma
uma película que dificulta a absorção de oxigênio, o que provoca a destruição
de algas e plânctons, prejudicando a alimentação dos peixes. De acordo com alguns
órgãos ambientais, o limite máximo de óleo na água é de 30mg/L. Com base nesse
parâmetro, quantos gramas de óleo poderão estar presentes em 1m3 de
água, sem comprometer o ecossistema? R:30
14. Determine
a massa de NaOH, em gramas, dissolvido em água suficiente para 300mL de
solução, cuja concentração comum é de 700g/L. R:210
15. Um
frasco de laboratório contém 2,0
L de uma solução aquosa de NaCl. A massa do sal
dissolvida na solução é de 120g. Que volume, em L, deve ser retirado da solução
inicial para que se obtenham 30g de sal dissolvido? R:0,5
 Ilustração 1 - O índigo é utilizado como corante nos blusões e nas calças de ganga.
Ilustração 1 - O índigo é utilizado como corante nos blusões e nas calças de ganga.






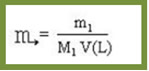

.jpg)















